Plantes génétiquement modifiées

Étape 2: Transférer le gène
Il existe plusieurs techniques de transferts qui se différencient par leurs propriétés de transfert soit directes soit indirectes.
A - Techniques de transfert direct
La transformation directe consiste en l'introduction dans l’ADN d'un gène véhiculé le plus souvent par un plasmide classique, par le biais de techniques physico-chimiques.
Il existe plusieurs techniques de transfert direct que nous allons expliciter : le transfert mécanique, l’électroporation, la micro-injection et la biolistique.
1 - Le transfert mécanique
On enlève la paroi pectocellulosique de la cellule receveuse, elle devient un protoplaste. On utilise alors le polyéthylène glycol (PEG), qui est un agent chimique possédant la faculté de déstabiliser la membrane plasmique des protoplastes. Les molécules d’ADN peuvent alors pénétrer dans la cellule et se greffer au génome.
=> L'action du PolyÉthylène Glycol (PEG)
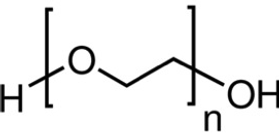
Le PEG est un polymère qui déstabilise de façon réversible les membranes plasmiques, permettant ainsi le transfert de l'ADN au travers de la membrane. Cette méthode a permis l'obtention de maïs résistant à une matière active herbicide, le glufosinate. Elle est également utilisée sur la betterave.
Structure moléculaire du polyéthylène glycol
2 - L’électroporation
L'électroporation est une des techniques les plus simples à mettre en œuvre. Elle consiste à soumettre un mélange de protoplastes et d'ADN à des chocs électriques. Le champ électrique provoque la déstabilisation de la membrane plasmique du protoplaste et conduit à l'ouverture des pores membranaires, facilitant ainsi le passage de l'ADN dans le noyau. Or, les protoplastes baignent dans une solution de plasmides. Ces derniers passent donc très facilement dans la cellule qui se trouve à son tour génétiquement modifiée.
Cette manipulation est possible car le phénomène d’ouverture des pores est réversible. En effet, si le choc électrique n'a pas été trop violent, la membrane peut alors reprendre son état initial. C’est grâce à cette technique que le riz, le maïs ou l’orge ont été transformés pour la première fois.
On peut schématiser cette technique ainsi :
3 – La micro-injection
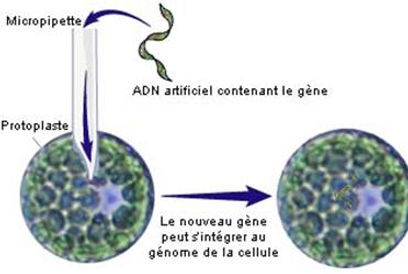
La micro-injection se réalise sur des protoplastes, dont nous avons vu précédemment la formation. L'opération consiste à introduire directement le gène étranger dans la cellule à modifier, à l'aide d’un micromanipulateur monté avec un microscope.
On maintient le protoplaste à transformer avec une micro-aiguille et on introduit le gène accompagné de son complexe promoteur-terminateur dans le noyau, à l’aide d’une micro-pipette. La cellule est alors génétiquement modifiée. Après l’injection, le protoplaste est libéré et mis en culture sur un milieu approprié.
Un promoteur est une séquence d’ADN placée en amont du gène et qui est nécessaire à sa transcription, c'est-à-dire à la formation d'un messager : l'ARN (Acide RiboNucléique), ce dernier étant une copie d'un brin de l'ADN qui est capable de sortir du noyau. Un terminateur est une séquence d’ADN présente en aval du gène et au niveau de laquelle l'élongation de l'ARN prend fin (fin de la transcription).
Cependant cette méthode ne s'applique que dans des cas particuliers car elle est complexe et lourde à utiliser : pour réussir l'opération, il faut injecter mille copies du gène dans l'espoir qu'une cellule puisse accepter cet ADN étranger.
4 – La biolistique
La biolistique, ou balistique biologique, est la méthode la plus courante. Elle consiste à propulser le transgène dans les cellules végétales.
On utilise des microbilles de métal enrobées d’ADN (billes d’or ou de tungstène de 1 à 3 µm de diamètre ). Elles sont projetées à grande vitesse sur les cellules à transformer afin de traverser leur paroi. La force de propulsion est obtenue soit par explosion d'une poudre dans une balle, soit par détente d'un gaz sous pression (l'hélium le plus souvent). Ces billes seront progressivement freinées en traversant les différentes couches cellulaires. Quelques-unes des cellules atteintes vont alors insérer spontanément les transgènes dans leur génome. Mais le noyau de la cellule intègre l'ADN de façon aléatoire. Il faudra environ quinze jours pour s'assurer que les nouveaux gènes introduit se sont bien intégrés au génome.
Cette méthode est très prometteuse, car elle permet de façon simple et rapide d'injecter de l'ADN dans une grande quantité de cellules sans passer par une phase protoplasmique, encore très mal maîtrisée chez certaines espèces. De plus, cette injection peut être réalisée sur un tissu non désolidarisé de l'organe d'origine.
C'est une méthode facile d'emploi qui a permis d'obtenir de nombreuses plantes transgéniques, notamment chez les monocotylédones, comme le maïs, le blé, le riz. C'est ainsi qu'a été obtenu le premier maïs résistant à la pyrale. En revanche, cette méthode a l'inconvénient de produire des plantes partiellement transformées, appelées chimères et parfois d'engendrer l'insertion de nombreuses copies du gène d'intérêt.
B - Techniques de transfert indirect
Il existe également d’autres procédés pour fabriquer un OGM : les techniques de transfert indirect. Celles-ci utilisent l’intermédiaire de bactéries qui véhiculent le transgène jusqu’à la cellule souhaitée. Nous allons voir comment ces méthodes sont mises en action concrètement.
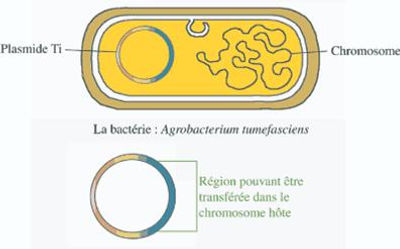
Le développement de la transgénèse végétale a connu son essor grâce à la découverte de bactéries telluriques phytopathogènes : Agrobacterium tumefaciens et Agrobacterium rhizogenes.
Ces micro-organismes sont capables de détourner à leur profit le métabolisme de certaines espèces végétales en faisant produire, aux cellules qu'ils infectent, des molécules nutritives (appelées opines) nécessaires à leur croissance. Il a été ainsi démontré que ce dérèglement cellulaire était dû à une véritable opération de génie génétique, dont les responsables sont des plasmides d'environ 200 kb : Ti et Ri.
En fait, suite à l'infection bactérienne, c'est l'intégration dans le génome de la plante d'un fragment de ces plasmides, le T-DNA, qui conduit au dérèglement métabolique. Les chercheurs ce sont donc servi de ces T-DNA pour pouvoir intégrer les gènes d'intérêt aux génomes des plantes.
1 – La transfection biologique
La méthode de la transfection biologique utilise les propriétés de certaines bactéries.
Prenons l’exemple de la bactérie, Agrobacterium tumefaciens, une bactérie en forme de bâtonnet, de la famille des Rhizobiacées. Elle se développe dans le sol.
Elle est attirée par des composés phénoliques (qui contiennent du phénol) dégagés par les plantes dicotylédones lorsqu’elles sont blessées. Au niveau de cette blessure, Agrobacterium est capable de se fixer sur les cellules du végétal. À la suite de ce contact, ces cellules végétales se multiplient de manière importante, donnant naissance à une formation tumorale. Elle est en général située au niveau du collet, d’où le nom de cette formation : la galle du collet (crown gall).
Les cellules de la galle libèrent des composés chimiques particuliers dans le milieu : les opines, molécules formées de deux acides aminés couplés. Les bactéries Agrobacterium présentes près de la galle, dans le sol, sont capables d’utiliser alors ces opines comme source d’azote, mais aussi de carbone et d’énergie. Agrobacterium tumefaciens est donc capable d’induire, chez une plante dicotylédone, la formation d’une galle lui fournissant un substrat. Depuis 1974, on sait que cette induction est due au transfert d’un petit ADN plasmidique depuis la bactérie jusque dans le génome des cellules de la plante.
1 / Première étape
Tout d’abord, on introduit le gène d’intérêt dans un plasmide. Pour cela, on utilise différentes enzymes, notamment une enzyme de restriction et la ligase.
On obtient donc un plasmide génétiquement modifié comprenant le gène d’intérêt.
Agrobacterium tumefaciens (tout comme, d’ailleurs, d’autres bactéries de la famille des Rhizobiacées) est donc capable d’injecter un ADN dans une cellule végétale où il s’insère dans le génome chromosomique. Cet ADN, qui peut circuler ainsi d’un organisme à un autre, est un fragment de plasmide (ADN circulaire bactérien de petite taille) : le plasmide pTi.
Agrobacterium réalise donc, naturellement, une transgenèse d’une partie de ses gènes (grâce à pTi) dans un organisme végétal. L’ADN qui est ainsi transféré est nommé ADN-T. Il a donc été rapidement proposé, une fois ce mécanisme connu, de le détourner dans un but de transgenèse. Pour cela, il « suffit » de remplacer l’ADN-T par un autre ADN portant un gène d’intérêt, par exemple.
Informations en lien avec le plasmide pTi
Le plasmide pTi est un petit plasmide, de 215 000 paires de bases. Ce plasmide comporte plusieurs régions :
ADN-T
Région transférée de la bactérie à la cellule végétale.
-
Cette région est flanquée de deux zones de bordures (FD à droite et FG à gauche), importantes pour la réalisation du transfert.
-
L'ADN-T comporte une région permettant le développement de la tumeur (galle) chez la plante infectée.
-
L'ADN-T comporte aussi les gènes permettant la synthèse et la libération des opines par les cellules végétales.
VIR
Région de virulence.
Cette région comporte une série de gènes, qui permettent la fixation de la bactérie aux cellules végétales et le transfert de l'ADN-T.
OCC
Région de catabolisme des opines.
Cette région permet à la bactérie d'utiliser les opines libérées par le végétal suite à son infection par l'ADN-T.
ORI
Région de réplication.
Cette région permet au plasmide de se multiplier dans la bactérie.
=> Un exemple de vecteur pour la transgénèse
La réalisation d’un vecteur de transgenèse par Agrobacterium tumefaciens implique donc de remplacer l’ADN-T, qui sera transféré, par le gène que l’on souhaite introduire dans le végétal. Il existe de nombreuses stratégies dans ce but. Les méthodes les plus complexes permettent désormais d’obtenir des plantes où le transgène se limite au seul gène d’intérêt, sans aucune séquence supplémentaire.
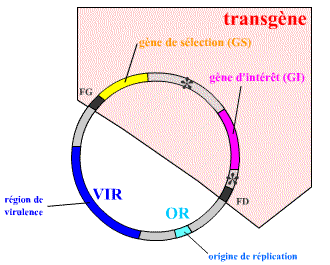
Le vecteur le plus simple à obtenir est un vecteur où l’ADN-T a été remplacé par un ADN comportant en particulier le gène d’intérêt (GI) accompagné d’un gène de sélection (GS) :
L’ADN-T est remplacé par un transgène, porteur d’un gène d’intérêt (GI) associé à un gène de sélection (GS). Du fait des techniques utilisées, certaines séquences bactériennes sont encore présentes dans cette construction simple ; elles sont notées sur la figure (les constructions plus récentes ne possèdent plus ou presque plus de séquences bactériennes). Ce vecteur est en fait obtenu après recombinaison entre un plasmide pTi modifié et un plasmide portant la construction transgénique.
Le gène de sélection permet de repérer facilement les cellules ou amas de cellules qui ont intégré l’ADN transgénique à leur génome. Il s’agit en général d’un gène permettant la survie de ces cellules dans certaines conditions particulières, ou bien d’un gène aboutissant à la présence d’une molécule repérable facilement.
2 / Deuxième étape
Dans un second temps, ce plasmide est transféré dans une bactérie, généralement de l’espèce Escherichia coli (E. coli). On cultive les colonies de E. coli transformées pour préparer le plasmide vecteur.
3 / Troisième étape
L’étape suivante a pour but de sélectionner les bactéries E. coli qui ont été transformées. Les bactéries ayant intégré le plasmide possèdent maintenant le gène d’intérêt, mais également un gène de résistance à un antibiotique particulier. Les bactéries sont donc placées dans un milieu de culture qui contient cet antibiotique. Les bactéries transformées génétiquement seront les seules à se développer dans ce milieu, c’est ainsi qu’elles sont sélectionnées.
4 / Quatrième étape
On intègre alors le plasmide transformé dans une plante à l’aide d’une autre bactérie : Agrobacterium tumefaciens (A. tumefaciens), qui possède la capacité à introduire des fragments précis de son ADN dans le génome des plantes. Le plasmide est transféré de E. coli à A. tumefaciens par choc thermique ou par conjugaison.
5 / Cinquième étape
Enfin, on place dans un milieu de culture commun des bactéries A. tumefaciens et un fragment de tissu végétal (un morceau de feuille ou de tige par exemple). Grâce aux propriétés de la bactérie, la partie du plasmide qui contient le gène d’intérêt est transférée dans le noyau de la cellule végétale qui l’intègre alors dans son génome.
La dernière étape est alors la régénération de plantes entières à partir de ces cellules. Malheureusement, cette méthode ne fonctionne que chez certaines espèces (tabac, colza, tomate, pomme de terre melon et tournesol).
2 – La lipotransfection
Le but de cette méthode est d’« emprisonner » le gène d’intérêt dans un liposome (structure sphérique constituée de lipides). Ceux-ci ont la capacité de fusionner avec la membrane de protoplaste, ils libèrent ainsi leur contenu (ici le gène d’intérêt) dans le cytoplasme du protoplaste. Cependant, seulement une minorité de ces gènes pourront parvenir jusqu’au noyau et s’intégrer par la suite au génome de la cellule, c’est pourquoi cette méthode est peu utilisée.
La transfection se fait en deux temps : d’abord des complexes sont formés entre les acides nucléiques et les lipides cationiques puis ils sont internalisés dans la cellule.
3 – L’agrologique
L'agrologique est une combinaison de 2 techniques, la biolistique et le transfert indirect par l'agrobactérie. L'agrologique est utilisée pour des plantes où l'une de ces techniques sont peu efficaces. On utilise alors simplement les microbilles pour provoquer des micros blessures dans les cellules qui seront ensuite soumises aux agro bactéries possédant le gène à transférer. Ces micros blessures facilitent l'envahissement des tissus par les agro bactéries et le rendement de la transformation est ainsi augmenté.
Cependant, il existe des inconvénients : les cellules souches d'Agrobacterium ont une grande spécificité d’hôte, ce qui limite son application aux espèces sensibles à son action. De plus, la bactérie peut survivre dans la plante pendant quelques mois , ce qui peut poser problème dans le suivi de la plante . Enfin il y a une quantité limitée d’ ADN transférable.