Plantes génétiquement modifiées
D’où vient la protéine Cry ?
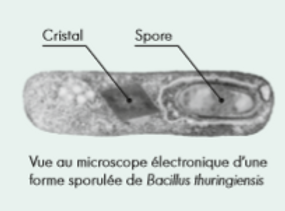
Lorsque les conditions environnementales deviennent défavorables, les bactéries condensent leur patrimoine génétique et dans certains cas, expriment des protéines en excès: cette forme est appelée spore, et est le résultat de la sporulation. Ces spores montrent une résistance accrue à des facteurs d'environnement défavorables, notamment à une température élevée, à l'absence d'éléments nutritifs ou à la dessiccation: c’est une forme de résistance. Une cellule ne peut donner qu'une seule spore.
Les protéines que Bacillus Thuringiensis (Bt) synthétise lors de sporulation, évoquées précédemment, sont les protéines Cry. Ces dernières s’accumulent sous la forme de cristal. Appelé cristal protéique, cette structure peut représenter jusqu’à 30 % du poids sec de la bactérie, et est responsable de l’activité insecticide de Bt.
La spore pourra être mangée par un prédateur, par exemple un nématode.
Après avoir été dissoute et modifié par protéase au sein du prédateur, la spore, et plus précisément les protéines Cry vont entraîner la lyse de l'épithélium. En outre, les conditions étant de nouveau favorables les spores vont pouvoir donner des bactéries: c'est la germination. Par conséquent, les bactéries se propagent et se développement à l'intérieur de l'organisme, menant à la mort de l'individu (en général par septicémie). La bactérie survit au fait d'être mangé.
Donc, l’existence des ces cristaux protéiques a été mise en évidence par l’effet insecticide de cette bactérie, ainsi que par la mort des nématodes, se nourrissant de débris animaux, végétaux ou fongiques où l’on trouve un grand nombre de bactéries.
Puis, s’inspirant du fonctionnement de la bactérie, on a décidé d’introduire le gène de la bactérie Bacillus Thuringiensis codant pour la sécrétion de la protéine Cry dans le génome du maïs. Du processus évoqué ci-dessus, on ne veut imiter que la production de la protéine Cry. Mais comment agit-elle?
Mode d’action de la protéine Cry
Différentes techniques permettent d’insérer dans le génome du maïs le gêne codant pour la protéine Cry, qui est dans le cas du maïs Bt le gène Cry1Ab.
Une fois le gène inséré dans le génome, la machinerie cellulaire du maïs va assurer la réplication, transcription et traduction de ce gène pourtant issu d’une autre espèce: ceci est permis grâce à l’unité du vivant pour lequel ces trois mécanismes se font de manière identique. Ainsi, une protéine Cry va être sécrété.
La transcription et la traduction : du gène à la protéine
La transcription est la première étape du processus qui permet de passer de l'ADN à la protéine. En effet, la transcription est un mécanisme biologique permettant la synthèse d'une molécule d’ARN à partir d'une molécule d'ADN par complémentarité des bases. Elle est catalysée par une enzyme : l’ARN polymérase. Chez les eucaryotes, la transcription se déroule dans le noyau.
Puis, cette ARN messager va aller dans le cytoplasme de la cellule. La synthèse des protéines va avoir lieu, par les ribosomes, à partir de l’information génétique contenue dans les ARN messagers. Le ribosome interprète l'information contenue dans l'ARNm sous forme de codons (triplets de nucléotides), qu'il traduit en acides aminés assemblés dans la protéine en utilisant le code génétique, selon l'ordre donné par les codons portés par l'ARNm.
La transcription suivie de la réplication
La réplication : du gène à un nouveau gène
La réplication de l’ADN est le processus au cours duquel l’ADN est synthétisé grâce à l’ADN polymérase. Ce mécanisme permet d'obtenir, à partir d'une molécule d'ADN, deux molécules identiques à la molécule initiale, en vue de leur distribution aux deux cellules filles pendant la mitose. Les nouvelles cellules ont le même génome: ici, elles vont avoir le gène codant pour la protéine Cry.
Schémas illustrant la réplication en détail, puis la chronologie réplication suivie de la mitose
Pour plus de d'informations sur la réplication, la transcription et la traduction : https://cpbxpgm.wixsite.com/ogm-et-pgm/replication-transcription-traductio
La protéine Cry peut être exprimée dans les chloroplastes de la plante par exemple, ceci est très favorable à l'environnement pour minimiser le franchissement des transgènes vers les mauvaises herbes et les cultures apparentées. Le gène Cry1Ab fait donc partie du matériel génétique qui se trouve dans les plastes des cellules végétales: le plastome. Il est également dans une position pré-décidée.
Cependant, on peut se demander si l'expression de Cry1Ab peut être néfaste pour la plante. Par exemple, si elle produit trop de cristaux la plante peut-elle en mourir ? Ainsi, on sélectionne la plante qui aura le meilleur rapport entre le développement de la plante et l'expression de la toxine Bt. En effet, les différentes variétés expriment différemment le gène cry1Ab, et en plus vient s'ajouter l'influence des facteurs externes, tels les conditions climatiques, la qualité du sol ou les pesticides qui changent aussi l'expression et la synthèse des protéines par des processus post-transcriptionnels.
La structure de la protéine Cry
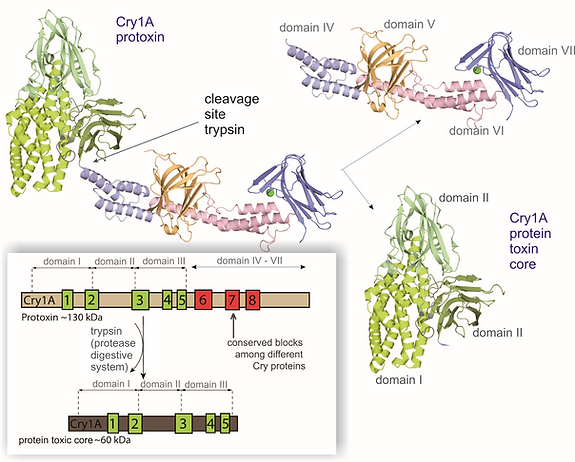
On a pu observer les structures tertiaires de plusieurs protéines Cry (pas celle de cry1Ab). En effet, il existe un grand nombre de protéines Cry, mais qui présentent beaucoup de points communs notamment au niveau de la structure et du mécanisme d'action (malgré les différents hôtes).
On retrouve dans les protéines Cry:
*Trois domaines qu'on retrouve dans toutes les protéines Cry
-Un premier composé de longues hélices alpha, permet la formation d’oligomères puis de pores
-Un second constitué de feuillets bêta, permet la spécificité à un récepteur
-Un troisième domaine, constitué de feuillets bêta, permet la spécificité à un récepteur
*Une autre partie, beaucoup plus variable d'une protéine à une autre (constituée de 4 domaines pour Cry 1 A).
Puis,
Cette protéine agit au niveau des cellules de l’épithélium intestinal: les entérocytes.
Comment la protéine Cry peut-elle endommager la cellule puis causer la mort de l'insecte ?
Représentation schématique du mode d'action de la protéine Cry dans le tube digestif de l'insecte (les différentes étapes sont surlignées en vert dans le texte).
A/ LA PROTEOLYSE PARTIELLE EST NECESSAIRE POUR EXPRIMER LA TOXICITE DE LA PROTEINE CRY
Lorsqu’elle est ingérée par la larve de l’insecte, principal ravageur du maïs Bt, la protéine Cry subit une protéolyse partielle au niveau du mésentéron à pH alcalin par les protéases digestives des sucs digestifs, notamment la trypsine et la chymotrypsine. Ces deux protéases digestives clivent les protéines, la trypsine le faisant après les acides aminés portant une charge positive et la chymotrypsine après les acides aminés aromatiques ou hydrophobes. Ce sont des protéases à sérine: leur site actif contient un résidu de sérine qui joue un rôle essentiel dans la catalyse.
Représentation de la trypsine et de la chymotrypsine :
On peut voir la position apicale de la trypsine et de la chymotrypsine.
A savoir, l'appareil digestif de l'insecte est constitué d'un long tube clos appelé le canal alimentaire et s'étend longitudinalement à travers le corps. Ce tube digestif dirige unidirectionnellement la nourriture de la bouche à l'anus. Il est divisé en trois parties dans le cas de l’insecte: stomodeum (intestin antérieur), mésentéron (intestin moyen) et proctodeum (intestin postérieur).
Lors de cette protéolyse partielle la partie de la protéine sensible aux protéases de l'insecte sera dissoute libérant des longues chaînes de protéine, qui pourront se fixer sur deux types de récepteurs à la surface de l’épithélium de l’intestin: la fraction active de la protéine Cry est libérée (étape 1). En effet, uniquement les domaines I, II, et III seront conservés.
En outre, une fois la protéine coupée, il est proposé que le site de fixation aux récepteurs ayant des domaines dits de "cadhérine" de la membrane soit accessible. Sinon, dans son état dimère par exemple, dit "full length" , ce dernier n'est pas accessible. Aucune modification de la structure n'est remarquée. Donc, la toxine ne devient active qu'après cette protéolyse; elle est inoffensive en soi.
Schéma illustrant libération de la partie active de la protéine toxique par la trypsine (protéase)
B/ VERS LES RÉCEPTEURS
Le tube digestif des invertébrés, ce qui est le cas des insectes, et donc de la pyrale du mais sont tapissés d’une membrane péritrophique qui ne laisse passer que les petites molécules, elle ne peut ainsi être traversée par les protéines que si elles sont partiellement coupées par les enzymes (étape 2)
La protéine va donc ensuite aller se fixer sur des récepteurs spécifiques présents à la surface des cellules épithéliales. La présence de récepteurs spécifiquement reconnus par chacune des protéines constitue l’étape essentielle du mécanisme d’action et de spécificité de ces toxines.
Ces récepteurs spécifiques sont pour la plupart:
*des transporteurs ABC, autrement dit transporteurs à ATP Binding Cassette, protéines transmembranaires dont le rôle est le transport unidirectionnel de part et d'autre de la membrane cytoplasmique des acides-aminés, sucres, polysaccharides, acides gras, peptides et ions. Ils utilisent l'hydrolyse de l'ATP comme source d'énergie pour ce transport et libèrent un groupement phosphate et de l'ADP. Ils effectuent donc d'un transport actif primaire.
Ces transporteurs constituent une grande famille d'ATPases.
*des glycoprotéines qui portent des domaines dits de « cadhérine » normalement impliqués dans l’adhérence cellule-cellule. Après la protéolyse, le site de fixation aux récepteurs possédant des domaines dits de « cadhérine » est libre, il est situé dans le domaine III. Il va pouvoir ainsi interagir grâce à une chaîne hydrocarbonée avec le domaine de cadhérine du récepteur selon le schéma suivant:
Ainsi, dans un premier temps, la protéine monomère se présente à un transporteur ABC par le domaine III, pour des raisons inconnues (étape 3), puis se fixe à un domaine dit de "cadhérine" dans une glycoprotéine (étape 4), ce qui va faciliter le changement conformationnel du domaine I. Ainsi vont se former des oligomères (étape 6) qui vont intéragir avec les transporteurs ABC par le domaine II (étape 5) et s’insérer dans la membrane (étape 7).
C/ LA MORT DU PRÉDATEUR
Vont suivre le gonflement (étape 8) puis la lyse des cellules (étape 9) épithéliales.
Les échanges ioniques sont perturbés par la présence de pores, on a donc un déséquilibre biochimique. En effet, les sucs digestifs passent dans l’hemocoele, cavité interne contenant l’hémolymphe (équivalent du sang chez les insectes) dans laquelle baignent les organes de l'organisme tandis que l’hémolymphe va dans le tube digestif (étape 9). Ainsi, suite à la présence des protéines se forment des pores membranaires qui vont permettre le libre échange de solutés à travers la membrane de l’épithélium (étape 9). Ce phénomène entraîne une paralysie du système digestif de l’insecte qui, ne pouvant plus s’alimenter meurt au plus tard 48 heures après avoir ingéré les protéines.
En outre, les autres bactéries présentes dans le tube digestif de la larve vont dans le sang, et se développent au détriment des insectes qui mourront par septicémie.
Cependant, les aspects moléculaires du mécanisme qui aboutissent à la mort des insectes ne sont pas encore clairement définis.
Pourquoi les protéines Cry sont spécifiques, et n’agissent que sur certains insectes ?
Plusieurs étapes sont donc nécessaires à l'obtention d'un effet toxique occasionné par les protéine Cry. Sous des conditions naturelles, c'est-à-dire dans son habitat, un insecte ou une larve doit, pour mourir:
-
ingérer la protéine, donc le capturer et l'avaler;
-
posséder un tube digestif à pH hautement alcalin;
-
posséder les enzymes protéolytiques capables de transformer protéines en molécules toxiques et finalement;
-
posséder les récepteurs membranaires adéquats, c'est-à-dire compatibles avec la partie de la protéine libérée par protéolyse.
Donc, les protéines de chaque sous-espèce de Bt n’agissent que contre une seule famille d’insectes spécifiques et préservent ainsi les auxiliaires: elles ne sont toxiques que pour certaines espèces. Il est donc ambigu de les appeler toxines en toutes circonstances, leur effet toxique se manifestant dans des conditions particulières.
Chaque souche de la bactérie Bacillus thuringiensis peut synthétiser divers types de protéines Cry, de 4 types I-IV. Selon le type, un groupe d’insectes leur est sensible (dû à la spécificité du récepteur).
On estime qu'au moins une centaine de gènes codant des protéines Cry ont été isolés à partir de différentes souches de Bacillus thuringiensis: cry1Ab est l’un de ces gènes. Selon le tableau ci-dessus, il est nuisible aux lépidoptères et principalement aux larves de la pyrale du maïs.
En outre, on peut conclure que ces protéines ne sont pas actives pour les plantes et les animaux.
Conclusion
Après ingestion de ces protéines Cry, on observe une protéolyse des ces dernières dans le pH alcalin de l’intestin. Les protéines peuvent alors traverser la membrane péritrophique et aller se fixer spécifiquement sur des récepteurs présents à la surface de l’épithélium intestinal, provoquant la formation de pores qui a pour conséquence la paralysie du tube digestif et la lyse des cellules épithéliales.






Trypsine et chymotrypsine
Schéma d'une cellule épithéliale

Schéma illustrant la structure de l'appareil digestif de l'insecte

Illustration de la protéine Cry1A sur le logiciel Pymol Viewer

Fixation de la protéine Cry par le site de fixation, dans le domaine III de la protéine, au domaine dit de "cadhérine" du récepteur

